
気液平衡の計算をエクセルでやりたいんだけど、どのような手順を踏めば良いんだろう?

今は高機能なプロセスシミュレータがあるので、ほとんど何も考えずに化工計算ができてしまうのがある意味悩みですよね。
シミュレーションソフトは値を入力して結果を出せますが、中身がどうなっているか良く分からず、①計算の中身がブラックボックス化している、②シミュレーションソフトの扱い方が難しい、などの弊害もあるようです。
そこで、こちらの記事では…
- エクセルを使って化工計算をしたい、そして計算の中身を少しでも理解したい方に向けて
- 化学工学で最もポピュラーな気液平衡計算を、事例を交えて解説
- 理想溶液、非理想溶液のグラフ作成ができる事を目標
上記の内容を解説します。
エクセルはあくまで表計算ソフトですが、特化していない分汎用性が高いため、ある程度の化学プロセス計算ができるツールです。
「これ以上は計算が複雑になりすぎてできない…」といった場面で、他の高機能なプロセスシミュレータに切り替えます。
簡単な四則演算でグラフ作成ができますので、一つずつクリアしていきましょう。
事前準備:エクセルの便利な機能
- ゴールシーク
- ソルバー

化工計算ではお馴染みのツールです。今回、VBAは使わないので割愛します。
ゴールシーク
ソルバー
エクセルを利用した気液平衡計算の手順(理想溶液)
- ベンゼンートルエン系の2成分を題材とする
- ベンゼン、トルエンの蒸気圧を求める
- Raoultの法則、Daltonの法則を利用して気液平衡を計算する
- 定温気液平衡、定圧気液平衡のそれぞれで手順を確認する
気液平衡は、蒸留を利用した成分分離をするために化学工業では古くから使われており、蒸留塔のプロセス設計には欠かせない技術です。
今回は、理想溶液としてベンゼンートルエンの2成分系気液平衡の計算を行ってみます。

多くの化学工学の教科書で扱われている基本的な系になりますので、練習するにはもってこいの題材と言えます。
Antoine式から蒸気圧を算出
- 蒸気圧データ集 or 実験から純物質のAntoine定数を調べる(Aspenでお馴染みのNISTより)
- 単位によってAntoine定数の値が変わるので単位を必ず確認(圧力、温度)
☞計算後に、必要に応じて単位換算する(圧力:kPa,mmHg,bar 温度:K,℃) - Antoine式を利用して蒸気圧曲線をグラフ化して確認する
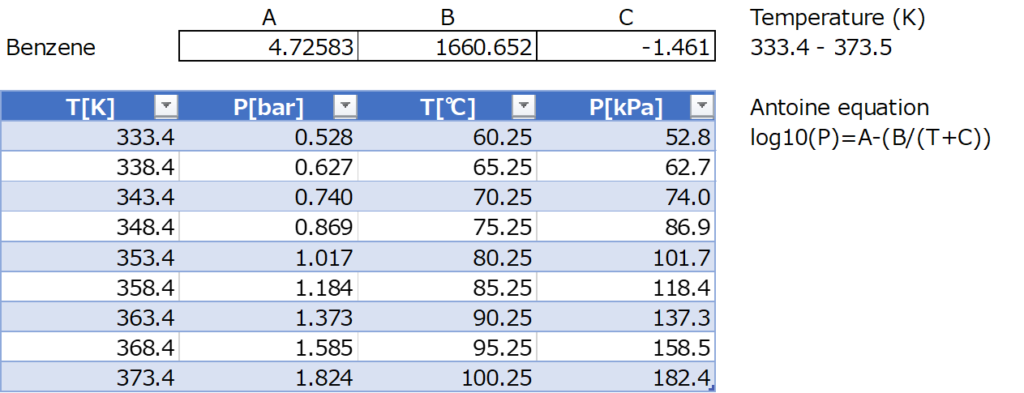
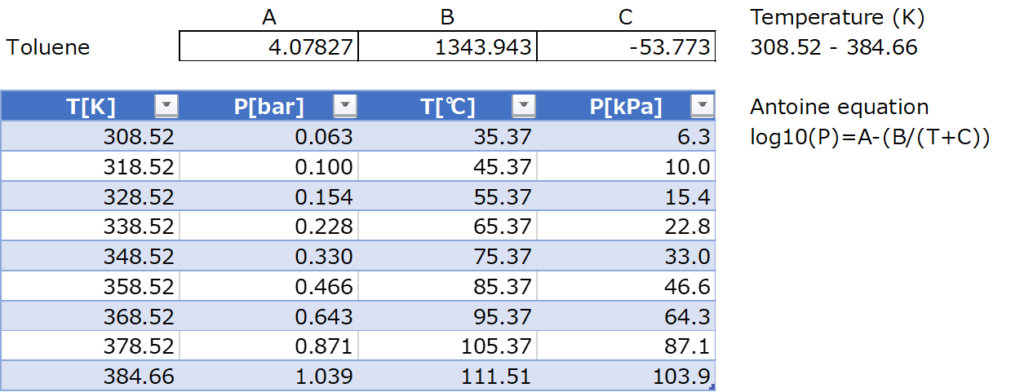
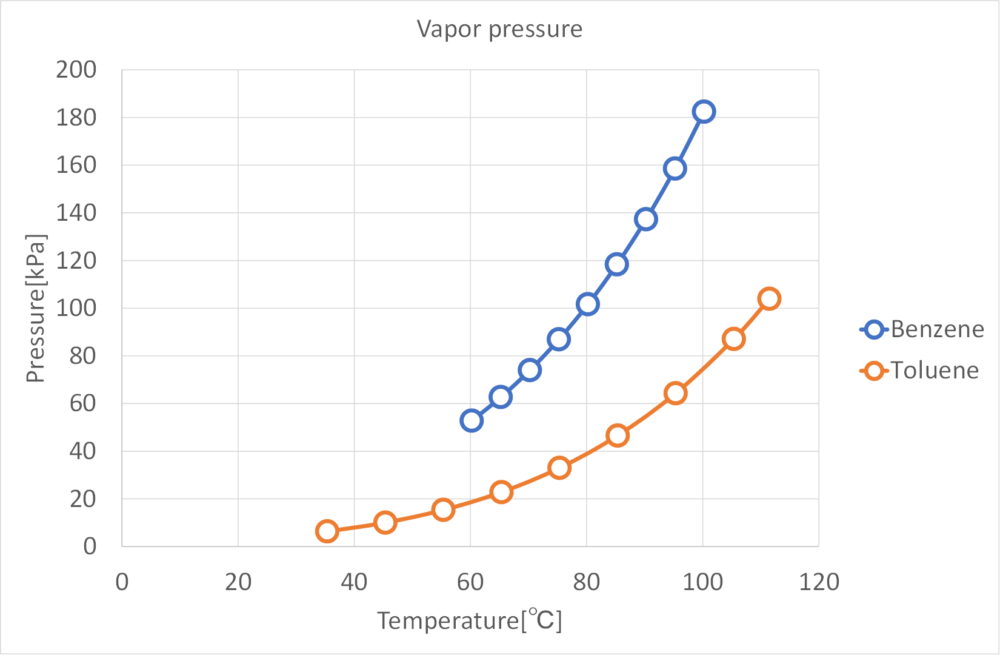
気液平衡の計算を行う際、始めに出てくるのがこのAntoineの蒸気圧式になります。純物質毎に式中の定数は異なるのですが、これは蒸気圧データ集から調べる事が一般的です。
このとき注意しなければならないのは…
このAntoine定数は、温度範囲内のときに利用できることを保証していますので、その温度から外れてしまうと正確な蒸気圧を計算できず、間違った気液平衡データを算出してしまいます。
高圧もしくは減圧の圧力条件における気液平衡を算出したい場合、その温度範囲が外れていたら、ラボ実験からその圧力における純物質の沸点を取得して、新たにAntoine定数を求めます。
なお、Antoine式に利用範囲がある理由は、『アントワン定数の算出法』を参照すると良いでしょう。
Antoine定数を求めるためにラボ実験する場合、使う装置は基本的に何でも構わいません。
精度を重視したい場合は、エブリオメーターを使うと良いでしょう。気液平衡測定の装置ですが、純物質の沸点データを取得する際にも利用します。
Antoine式とは?
ここではエクセルを利用して気液平衡を計算する事がゴールになりますので、Antoine式の説明は割愛します。詳しく知りたい方がいれば、わいけみ(@ychemi1)さんの「【蒸留】導入編② 蒸気圧を表す式 ~Antoine(アントワン)式~」を参照すると良いでしょう。
Raoultの法則、Daltonの法則を利用して気液平衡を計算する
- 液相組成xを0~1のモル分率の範囲で設定(今回は0.1刻みで設定)
- Antoine式、Raoultの法則、Daltonの法則、設定した液相組成xから気相組成yを求める
- 定温と定圧で計算方法が少し異なる
- 定温(xy,Pxy線図)、定圧(xy,Txy線図)をグラフ化して理想溶液は完成
Antoine式を利用した蒸気圧の求め方が分かったところで、いよいよ本題の気液平衡の計算になります。
ここでは、先ほどのAntoine式に加えて、Raoultの法則、Daltonの法則を利用します。まずは、任意に液相組成を設定して、上記3つの式を使って気相組成を求めていきます。
ここで、気液平衡にも2つの種類があり…
上記のように違いがあります。
それぞれ、計算方法とグラフ作成し、その違いを見ていきましょう。
定温気液平衡の場合
- 今回は80℃に温度を設定
- Antoine式から80℃(353.15 K)のときの蒸気圧を求める
- 液相組成のモル分率を0.1刻みで割り振る
- ベンゼン、トルエンそれぞれで、液組成毎の分圧を求める
- Daltonの法則から、ベンゼン、トルエンの分圧を足して、全圧を求める
- Raoultの法則から、ベンゼン、トルエンの分圧を全圧で割り、気相組成を求める
- 最後に、xy線図、Pxy線図をグラフ化し完成
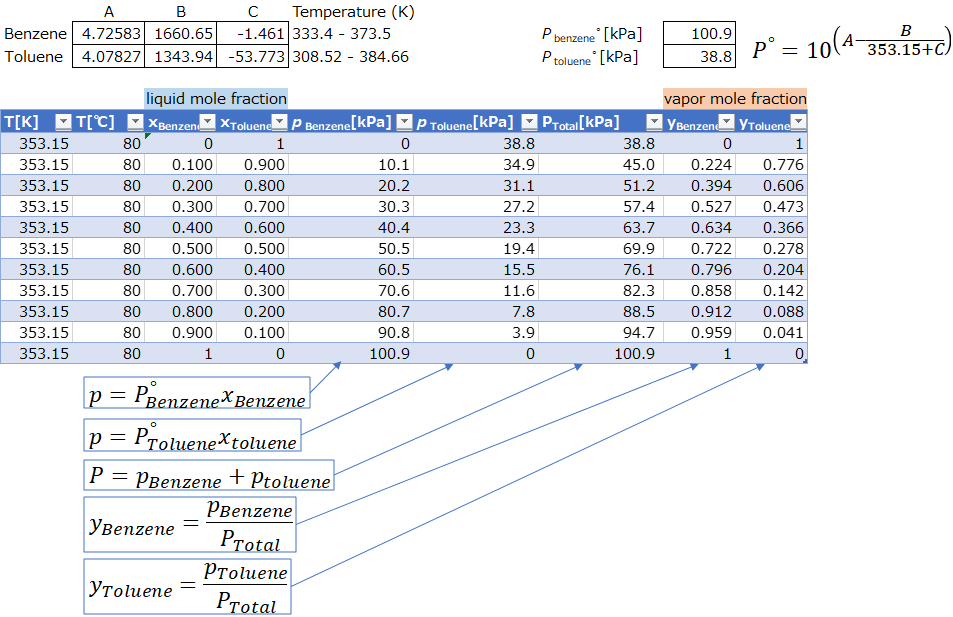
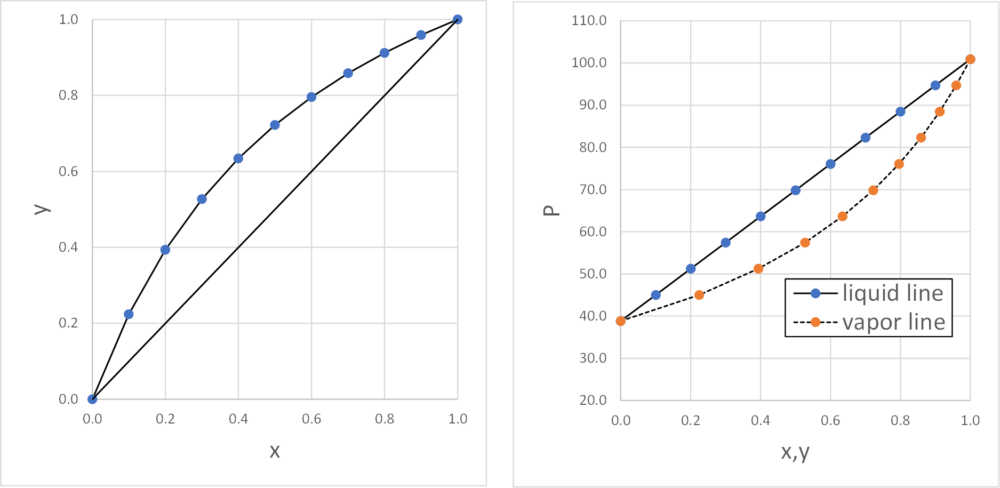
定温気液平衡の場合は、上記の表とグラフのようになれば完成です。
式の入力は面倒ですが、温度一定の場合は素直に式へ値を入れるだけで結果が出てきますので、それほど難しくはなかったのでは無いでしょうか。
定圧気液平衡の場合
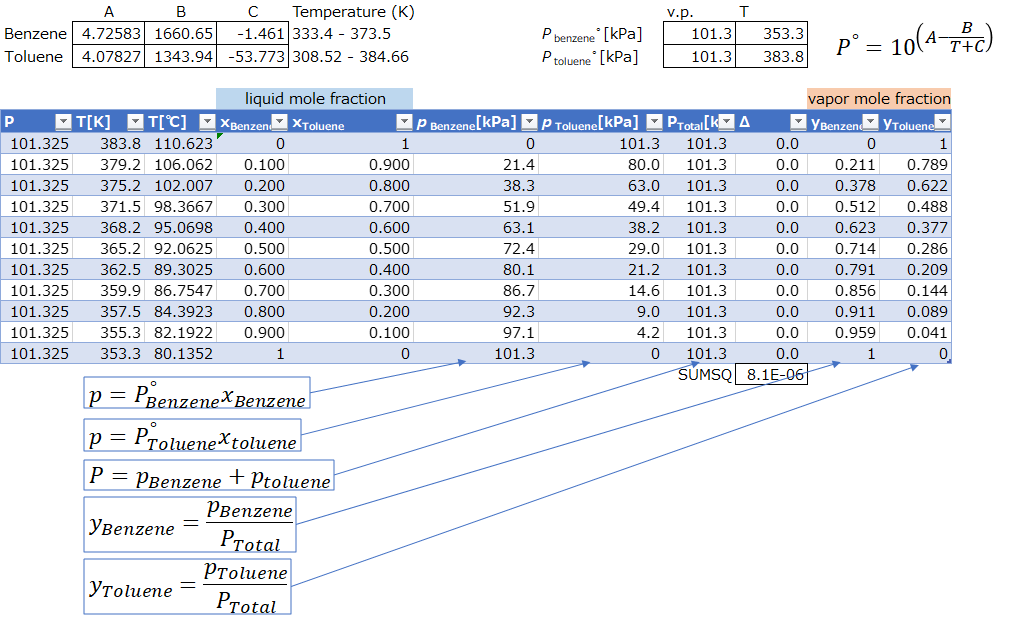
- 今回は常圧(101.325 kPa)に圧力を設定
- Antoine式から常圧のときの沸点をゴールシークから逆算し、温度範囲を確認する
- What-If分析の項目からゴールシークを選択
- 数式入力セルはv.p.列のセルを選択
- 目標値は常圧
- 変化させるセルは隣のセルを選択
- 液相組成のモル分率を0.1刻みで割り振る
- 温度範囲の中で、液組成毎の沸点を仮定で入力する
- ベンゼン、トルエンそれぞれで、液組成毎の分圧を求める
- Daltonの法則から、ベンゼン、トルエンの分圧を足して、全圧を求める
- 設定した圧力条件(101.325 kPa)と、仮定した温度によって求めた全圧の差Δを計算する
- 差Δの平方和をSUMSQ関数により求める
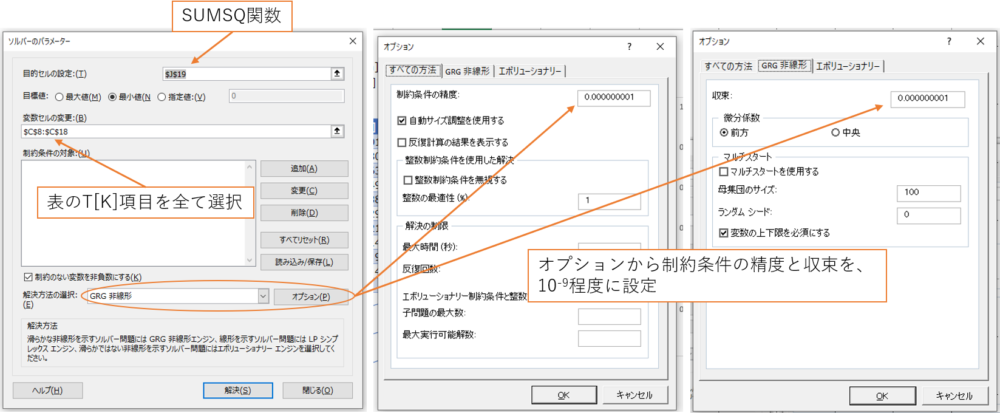
- ソルバーを使って、SUMSQ関数の平方和が最小になる温度T[K]を逆算する
- 目的セルの設定にはSUMSQ関数のセルを選択
- 目標値は最小値
- 変数セルの変更は、T[K]の項目を全て選択
- オプションから制約条件の精度と収束を10-9程度に設定
- 最後に解決をクリックする
- Raoultの法則から、ベンゼン、トルエンの分圧を全圧で割り、気相組成を求める
- 最後に、xy線図、Pxy線図をグラフ化し完成
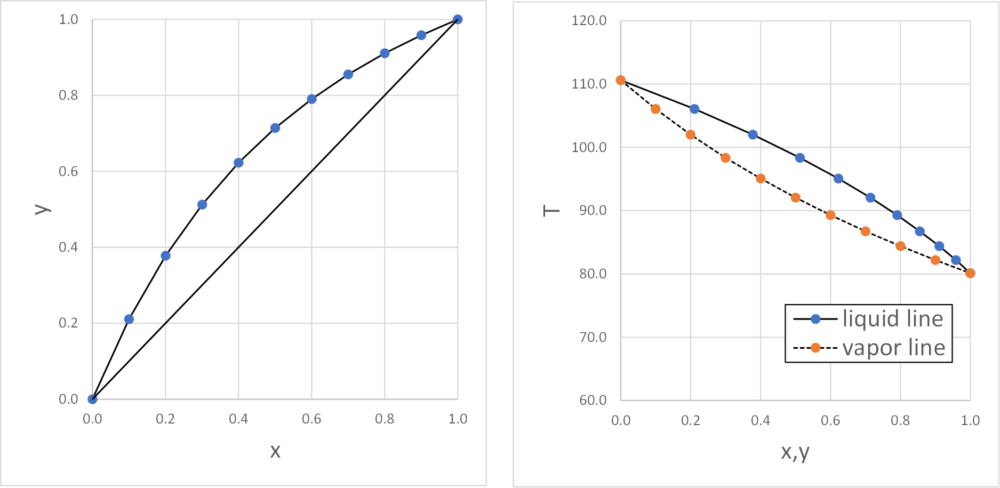
定温気液平衡と異なる作業には、手順の項目において黄色のアンダーラインで示しています。
定圧気液平衡の場合は、圧力が一定で純物質の温度(沸点)は分かるのですが、混合物の温度については最初分からない状態からスタートします。
なので、温度を仮設定してあげて全圧を算出するのですが、そのとき圧力は一定なので常圧の値になっていなければなりません。
しかし、適当に仮設定したので、当然実際の圧力と計算によって出した圧力に差が生じています。
この差を0にするための温度を逆算してあげれば、正規の温度が出てくる訳です。

ここでその逆算できる手法としてゴールシークがあるのですが、これを一つずつやっていくのは大変面倒くさいです…。
そこで、登場するのがソルバーです。
ソルバーというエクセルの機能を使う事によって、面倒な作業をボタン一つで解決することが出来ます。
学生の頃は講義の一環でエクセルを使わずに出していましたが、温度を逆算するには試行法を使わざるを得なかったので、大変面倒だったのを覚えています。
Raoultの法則とは?
上記に高校化学のとき習ったDaltonの分圧の法則を利用すれば全圧を求められますので、最後に気相成分が求められる、という手順になります。
今回の記事の目的上、Raoult、Daltonの法則や、気液平衡の原理に関する説明もAntoine式と同様に割愛しています。それぞれの定義を詳しく知りたい方は、こーし(@mimikousi)さんの「【ラウールの法則】気液平衡とは?(理想溶液編)」を参照すると良いでしょう。
エクセルを利用した気液平衡計算の手順(非理想溶液)
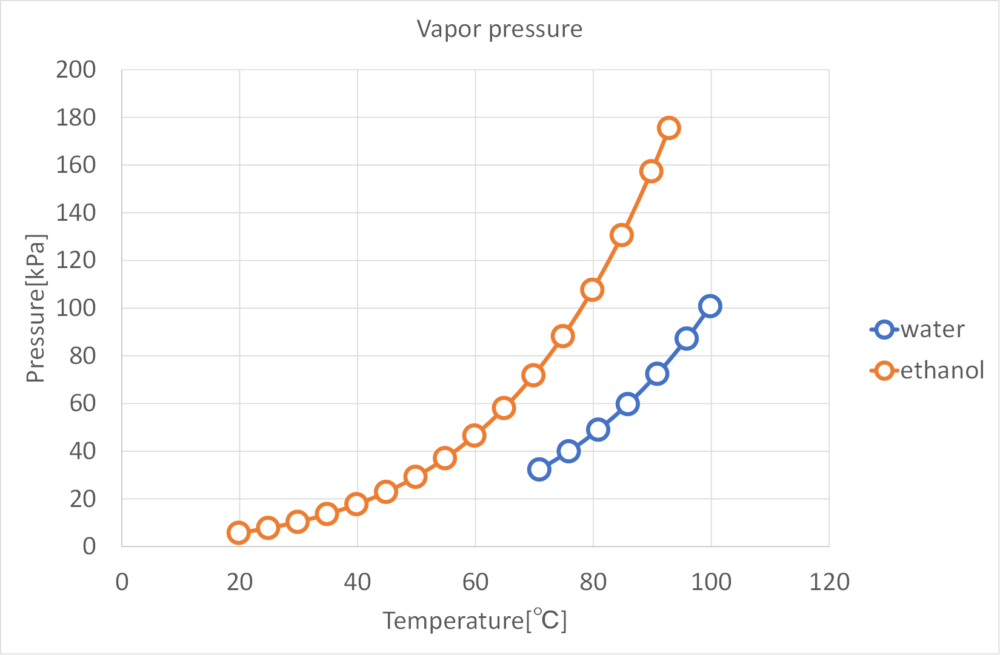
- 水ーエタノール系の2成分を題材とする
- 水、エタノールの蒸気圧を求める
- 活量係数式の選択と活量係数のパラメータを調べる
- 今回は、予め活量係数が分かっているものを使う
- 活量係数によりRaoultの法則を修正、Daltonの法則を利用して気液平衡を計算する
理想溶液では、Raoultの法則が成り立つ系で気液平衡の計算を行うことができました。
しかし、Raoultの法則が成り立たない系では活量係数を導入するなど、理想溶液とは少々異なるアプローチが必要になります。
活量係数式の種類と選択
活量係数式について詳しく知りたい方は、ルート(@Route_reviewer)さんの「化学工学用語集」を参照すると良いでしょう。
Antoine式、Raoult・Daltonの法則、活量係数式を利用して定圧気液平衡を計算する
- 蒸気圧データ集 or 実験から純物質のAntoine定数を調べる
- エタノール:A=5.24677 B=1598.673 C=-46.424(292.77~366.63 [K]、Pressure[bar])
- 水:A=5.08354 B=1663.125 C=-45.622(344.~373. [K]、Pressure[bar])
- Antoine式:log10(P)=A-(B/(T+C))
- 101.3 kPaのときのWilson parameterを調べる
- ここでは、Λ12=0.2162 Λ21=0.7913とする(化学工学-解説と演習-より)
- 理想溶液の定圧気液平衡を求める手順で、非理想溶液も同様に算出する
- エタノール、水の分圧計算に活量係数をかける
- 活量係数の計算にはwilson式を利用する
- エタノール、水の液組成がそれぞれ0のとき、wilson無限希釈活量係数式を利用する
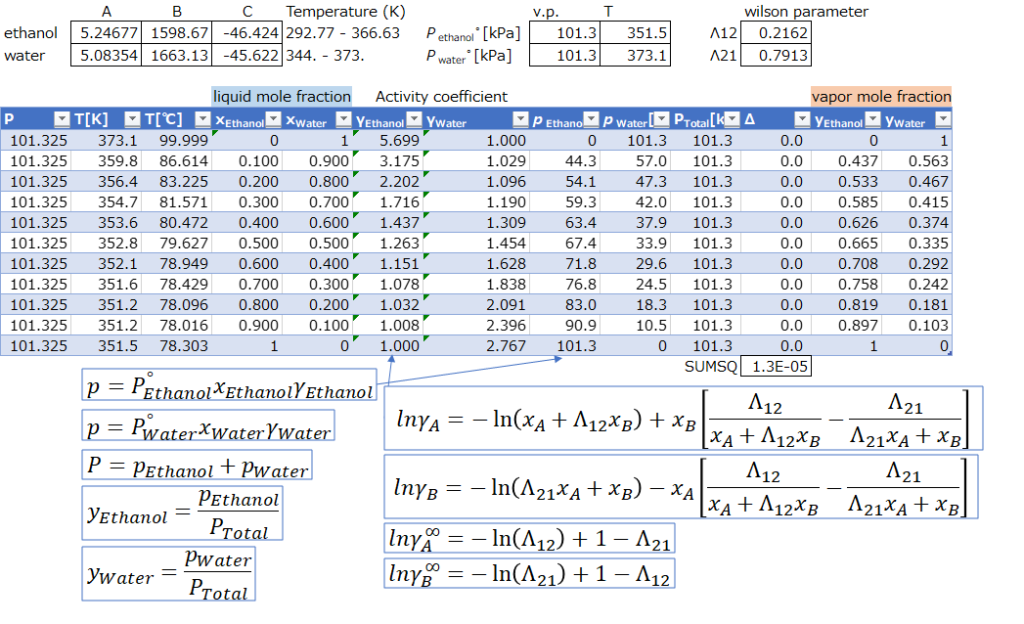
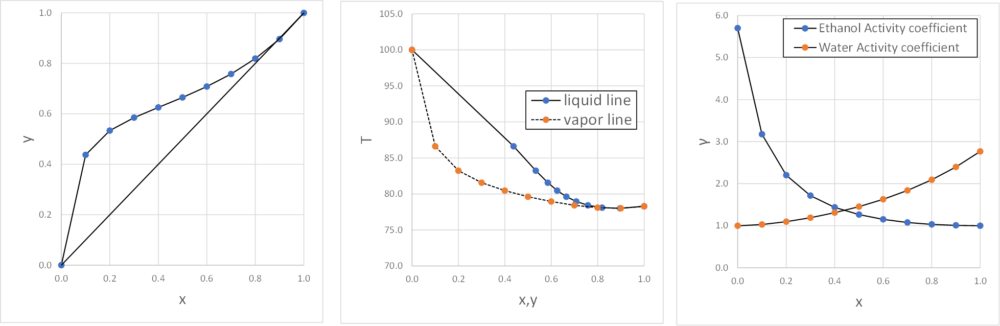
エタノールー水系の定圧気液平衡の場合は、上記の表とグラフのようになれば完成です。
グラフ作成までの方法は定圧気液平衡を求める手順と同様ですが、間に活量係数式を入れる必要があり、かつ式が長いため、割と混乱することもあったかと思います。
グラフを見てもお分かりいただける通り、理想溶液のグラフとはえらく形が違いますね。
エタノールー水系では上記の形ですが、他の組み合わせではまた違った形になるので、それぞれグラフを見てどのように蒸留すれば上手く成分を分離できるか判断します。

さらに余談ですが、通常の方法で限界まで蒸留して製造したお酒が、ポーランドを原産地とするウォッカで有名なスピリタスになります。
書籍紹介
続いて、エクセルを利用した化学工学の計算を学びたい方に、下記3つの書籍を紹介します。
- Excelで気軽に化学工学
- Excelで気軽に化学プロセス計算
- 化学工学のための数値計算
Excelで気軽に化学工学
Excelで気軽に化学プロセス計算
化学工学のための数値計算
理系の就職・転職サービスのご紹介
最後に、理系に特化した就職・転職サービスのご紹介です。
アカリク

UZUZ
転職第二新卒や既卒の就職・転職においても、大手の人材紹介企業を通じて新たな職場へ行くという事がありますが、以下の点でデメリットを感じている方もいると思います。
要するに、ブラック企業と呼ばれるもので、よく情報を吟味しないと誤って入社してしまう確率が高くなります。
そこで、理系に特化した就職・転職サービスをご紹介します。

こちらの就職・転職サービスの特長として、以下のメリットが挙げられます。
私も20代で転職した経験がありますが、面接対策や書類添削などのサポートは無かったため、その点で苦労をしました。
今は転職する人にとって追い風となっておりますので、このようなサービスは積極的に活用しましょう。
まとめ
今回は、「エクセルによる気液平衡の計算」をテーマに紹介してきましたが、いかがでしたでしょうか?上記の内容をまとめると…
- 理想溶液
- 各成分の蒸気圧を求めるため、Antoine定数を調査
- Raoultの法則、Daltonの法則から定温気液平衡、定圧気液平衡を求める
- 定圧気液平衡を求める際はソルバーを利用する。
- 非理想溶液
- 活量係数式の選択と活量係数のパラメータを調べる
- 気液平衡の計算には上記の活量係数を含める
- それ以外の方法は理想溶液の気液平衡の求め方と同様
以上のようになります。
社会人で使える化学工学に関するウェブサイトを知りたい方は、下記の記事を参照ください。
プロセス開発をどのように進めたら良いか、その考え方を知りたい方は、下記の記事を参照ください。
高機能なソフトが様々開発されていますが、基礎を学ぶにはエクセルを利用した化工計算がもってこいです。
化学工学の基礎を学びたい方は、是非エクセルを利用してチャレンジしてみて下さい。


最後までご覧いただき、ありがとうございました!







コメント